 |
毎日コラム
注目される遺伝子治療
注目される遺伝子治療

がんや難病に効く遺伝子治療薬が欧米で相次ぎ承認されている。
遺伝子治療が最も進んでいるのはアメリカで、出遅れていたヨーロッパも最近は体制を整えて、積極的に研究に参入している。
遺伝子治療薬は、外部から入れた遺伝子を体の中で働かせて疾患を治療する薬。
欧米や中国などで実用化されている。
遺伝子の入れ方などが改善され、12年に欧州で初の遺伝子治療薬が承認された。
遺伝子治療は過去に副作用死が出て敬遠されたが、安全性を高める工夫が進み再び脚光を浴びるようになった。
この価格は、1回のラクスターナ使用が持つ人生を変えるような画期的な価値を反映しているだけではなく、当社がラクスターナのみならず他のパイプライン(新薬候補)を支える革新的な科学技術に投資し続けていくことを可能にしたと言える。
昨年末に米国で初めて承認された遺伝子を注射するタイプの薬も含め、これまでに米欧で6製品が出ている。
世界では2500件を超える臨床試験が進行中だ。今後、新薬の承認が相次ぐとみられる。
一方で、日本は企業の臨床試験は、数件どまりになっている。
遅れの背景には、遺伝子治療への漠とした不安がある。製薬企業も失敗を恐れ、費用のかかる臨床試験になかなか踏み切らない。被験者も集めにくい。
政府が実用化を急ぐ再生医療も細胞に遺伝子を入れている。安全確認は大事だが、遺伝子と聞くだけで過度に恐れていては海外との差が広がる一方だと言う。
再生医療等製品への条件および期限付承認制度が導入された。
国が開発を促している再生医療等製品に該当し、通常1年かかる審査が短縮され、早期に承認の判断が下される。
日本も最新の研究成果を踏まえ利用を推進すべきだ。
そんな中で、創薬ベンチャーのアンジェス<4563>は、1月22日、開発を進めていた遺伝子治療薬について、厚生労働省に製造販売の承認を申請した。
厚労省は通常より短期間で審査し、可否を判断する。
アンジェスは2018年中の発売をめざしており、承認されれば遺伝子治療薬として国内初となる。
遺伝子治療には、変異した遺伝子や欠損した遺伝子を直接修復または補う治療と、遺伝子そのものを薬として利用する2通りの考え方があるが、アンジェスの場合は後者だ。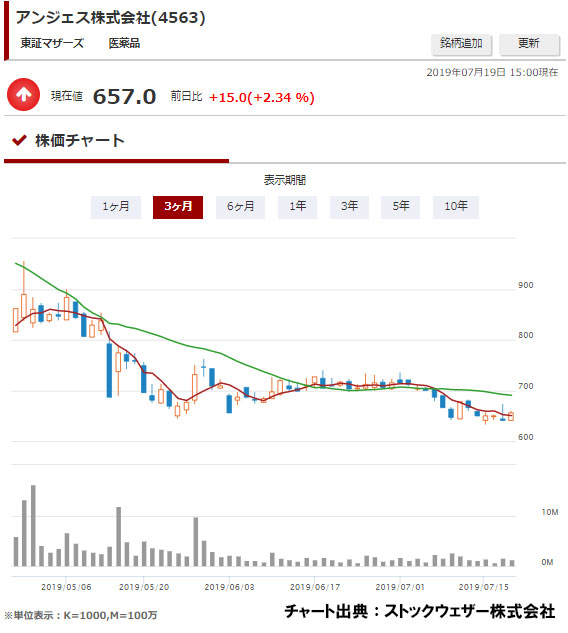
遺伝子治療が最も進んでいるのはアメリカで、出遅れていたヨーロッパも最近は体制を整えて、積極的に研究に参入している。
遺伝子治療薬は、外部から入れた遺伝子を体の中で働かせて疾患を治療する薬。
欧米や中国などで実用化されている。
遺伝子の入れ方などが改善され、12年に欧州で初の遺伝子治療薬が承認された。
遺伝子治療は過去に副作用死が出て敬遠されたが、安全性を高める工夫が進み再び脚光を浴びるようになった。

この価格は、1回のラクスターナ使用が持つ人生を変えるような画期的な価値を反映しているだけではなく、当社がラクスターナのみならず他のパイプライン(新薬候補)を支える革新的な科学技術に投資し続けていくことを可能にしたと言える。

昨年末に米国で初めて承認された遺伝子を注射するタイプの薬も含め、これまでに米欧で6製品が出ている。
世界では2500件を超える臨床試験が進行中だ。今後、新薬の承認が相次ぐとみられる。
一方で、日本は企業の臨床試験は、数件どまりになっている。
遅れの背景には、遺伝子治療への漠とした不安がある。製薬企業も失敗を恐れ、費用のかかる臨床試験になかなか踏み切らない。被験者も集めにくい。
政府が実用化を急ぐ再生医療も細胞に遺伝子を入れている。安全確認は大事だが、遺伝子と聞くだけで過度に恐れていては海外との差が広がる一方だと言う。

再生医療等製品への条件および期限付承認制度が導入された。
国が開発を促している再生医療等製品に該当し、通常1年かかる審査が短縮され、早期に承認の判断が下される。
日本も最新の研究成果を踏まえ利用を推進すべきだ。
そんな中で、創薬ベンチャーのアンジェス<4563>は、1月22日、開発を進めていた遺伝子治療薬について、厚生労働省に製造販売の承認を申請した。
厚労省は通常より短期間で審査し、可否を判断する。
アンジェスは2018年中の発売をめざしており、承認されれば遺伝子治療薬として国内初となる。

遺伝子治療には、変異した遺伝子や欠損した遺伝子を直接修復または補う治療と、遺伝子そのものを薬として利用する2通りの考え方があるが、アンジェスの場合は後者だ。

株式投資は全て自己責任でお願いします。このサイトの情報は投資の勧誘を目的としたものではなく、投資の参考となる情報の提供を目的としたものです。当サイトの掲載事項において損失をされた場合も当方は一切の責任を負いかねます。
(C)ilogos / Eimei.tv
(C)ilogos / Eimei.tv